Atomul
Atomul este o particulă componentă a substanţelor, ce are caracteristici bine determinate:
– este o particulă extrem de mică, cu formă sferică
– este neutru din punct de vedere electric
– se conservă în reacţiile chmice.
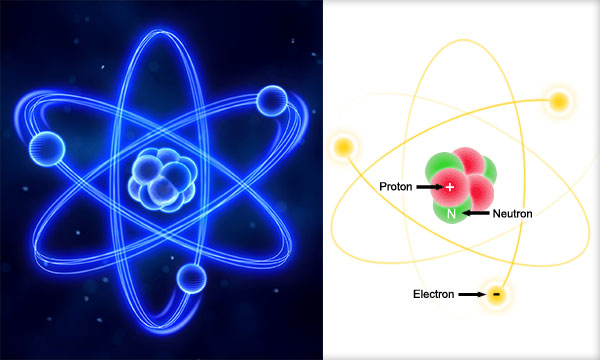
Atomul este alcătuit din particule mult mai mici, particule subatomice, numite protoni, neutroni şi electroni.
Particulele subatomice
Corpul central al atomului, numit nucleu atomic, este format din protoni şi neutroni.
Electronii gravitează în jurul nucleului atomic, formând învelişul de electroni.
Caracteristicile particulelor subatomice
Principalele caracteristici ale particulelor subatomice (protoni, neutroni, electroni) sunt masa şi sarcina electrică.
Masele absolute sau masele reale sunt masele exprimate în kilograme.
Masele relative sunt determinate în raport cu unitatea de masă atomică, definită ca a 12-a parte din masa atomului 126C şi notată cu u. Izotopul 126C este atomul de carbon care are în nucleu 6 protoni şi 6 neutroni.
1u = m126C/12 = 1,66 · 10-27 kg
Sarcinile electrice absolute sau sarcinile reale sunt sarcinile electrice exprimate în coulombi (C).
Sarcinile electrice relative sunt determinate în raport cu sarcina electrică a protonului qproton = 1,6 · 10-19 C.
Protonul şi neutronul au mase aproximativ egale cu a 12-a parte din masa atomului de carbon, izotopul 12.
Electronul are masa aproximativ de 1823 de ori mai mică decât a 12-a parte din masa atomului de carbon, izotopul 12.
Protonul şi electronul au sarcini electrice egale şi de semn opus, sarcina electrică a protonului fiind pozitivă şi a electronului negativă.
Într-un atom, care este neutru din punct de vedere electric, numărul de electroni din învelişul de electroni este egal cu numărul de protoni din nucleu.
Neutronul este o particulă neutră din punct de vedere electric.
Numărul atomic, notat cu Z, indică numărul de protoni din nucleul unui atom.
Numărul de masă, notat cu A, indică suma dintre numărul de protoni şi numărul de neutroni din nucleul unui atom.
