I. Legături chimice
1. Ce sunt legăturile chimice
Legăturile chimice sunt interacţiuni puternice care se stabilesc între atomi cu participarea electronilor de valenţă.
2. Ansambluri formate prin legături chimice
În substanţe, atomii nu se află izolaţi, ci sunt uniţi între ei prin legături chimice.
Aceştia sunt uniţi în ansambluri mai mari, de tipul:
a) moleculelor;
b) reţelelor cristaline.
3. De ce depind proprietăţile substanţelor
Proprietăţile substanţelor depind de:
a) natura particulelor componente (atomi, ioni, molecule);
b) natura interacţiunilor ce se exercită între aceste particule.
4. Tipuri de legături chimice
Se cunosc trei tipuri de legături chimice, diferenţiate între ele prin modul de realizare:
a) legături ionice;
b) legături covalente;
c) legături metalice.
II. Legătura ionică
1. Cum se realizează legătura ionică
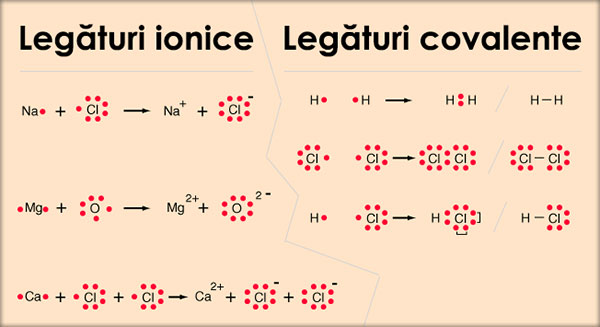
Legătura ionică se realizează prin:
a) transfer de electroni;
– de la atomii elementului cu caracter metalic pronunţat;
– la atomii elementului cu caracter nemetalic pronunţat.
b) stabilirea forţelor de atracţie electrostatică.
– între ionii de semn contrar formaţi.
2. Simbolul Lewis
Un simbol Lewis este format din:
a) simbolul unui element;
b) punctele care înconjoară simbolul elementului.
– prin puncte sunt reprezentaţi electronii de pe ultimul strat.
3. Structura Lewis
O structură Lewis este o reprezentare a:
a) legăturilor chimice dintre atomii unei molecule;
b) perechilor de electroni neparticipanți care există în moleculă.
III. Legătura covalentă
1. Cum se realizează legătura covalentă
Legătura covalentă se realizează prin:
– punere în comun de electroni.
Când atomii nemetalelor se combină între ei, dobândesc configuraţiile stabile de gaz nobil, pe ultimul strat, prin punere în comun de electroni.
2. Exemplu (H2)
Atomul de hidrogen (1H: 1s1) tinde să dobândească configuraţia 1s2 a heliului, gazul nobil cel mai apropiat de hidrogen în tabelul periodic.
În acest scop, doi atomi de hidrogen se vor apropia până când îşi vor întrepătrunde orbitalii 1s, rezultând un nou orbital, numit orbital molecular de legătură.
În acest orbital molecular, care înconjoară ambele nuclee de hidrogen, gravitează cei doi electroni, câte unul de la fiecare atom de hidrogen.
Cu alte cuvinte, cei doi atomi de hidrogen au pus în comun câte un electron.
Perechea de electroni pusă în comun aparţine, în egală măsură, fiecărui atom de hidrogen.
Ea se reprezintă printr-o liniuţă, numită covalenţă, pusă între simbolurile chimice H-H.
Cei doi atomi de hidrogen sunt astfel legaţi între ei, formând molecula de hidrogen, cu formula chimică H2.
Exemple: legături ionice, legături covalente